由慢性炎症向肿瘤的转化是临床医学领域长期面临的重大挑战,其中炎症性肠病(IBD) 患者发展为结直肠癌(CRC)的风险显著高于普通人群,而信号转导与转录激活因子 3(Signal transducer and activator of transcription 3,STAT3)作为 JAK-STAT 信号通路的核心分子,扮演着“双刃剑”的角色。生理状态下 STAT3 维持肠道免疫平衡与上皮修复,保障肠道稳态;但在慢性炎症持续刺激下,其异常激活会驱动细胞失控增殖,诱发癌变。尽管STAT3 与炎症-肿瘤转化的关联早已明确,但 STAT3 在生理与病理状态下的差异化调控机制始终未被破解。抑制 STAT3 全功能的治疗策略因极易诱发严重副作用,导致临床转化应用屡屡受阻,成为制约靶向 STAT3 对 IBD 与CRC 精准治疗的关键瓶颈。
一种此前被忽视的STAT3 剪接变体,正为破解这一困境提供关键线索。2025 年 12 月10 日,华中师范大学生命科学学院仝晶晶团队联合中国医学科学院阜外医院王志华团队, 在 Science Translational Medicine 在线发表题为“A hyperactive splice variant of STAT3 promotes colonic inflammation-associated tumorigenesis in mice“的研究论文。该研究发现 STAT3 的 21 号外显子存在一个隐含剪接位点,会选择性产生两种仅相差一个氨基酸(第 701 位丝氨酸,S701)的蛋白亚型——含 S701 的STAT3_wS701 亚型与缺失 S701 的 STAT3_ΔS701 亚型。正是这一个氨基酸的“有无”,让 STAT3 的功能天壤之别:前者自带“分子刹车(S701)”,能避免炎症失控;后者则因缺失“刹车”,成为驱动结肠炎症-肿瘤转化的“超活跃加速器”。这一发现不仅揭示了炎症向癌症转化的全新分子机制, 更为 IBD 与 CRC 的精准诊断、靶向治疗开辟了新路径。

研究团队聚焦STAT3 的“蛋白异质性”,通过结构模拟、质谱分析与特异性抗体开发,证实了两种亚型的功能差异:对于 STAT3_wS701 亚型,在炎症信号刺激早期,S701 位点优先磷酸化(p-S701),这个磷酸化修饰给紧邻的 STAT3 激活关键位点 Y705 盖上“保护盖”,阻碍上游酪氨酸激酶(JAK1/2)与 Y705 结合,从而限制 Y705 的磷酸化,避免炎症信号过度放大——相当于为 STAT3 装上“分子刹车”,维持细胞信号稳态。而 STAT3_ΔS701 亚型, 天然缺失这一“刹车”系统:炎症刺激下,其 Y705 位点能更快、更强地被磷酸化,进而猛烈激活下游促炎基因(如 TNFα、IL-6)与促癌基因(如 BCL-2、c-MYC、Cyclin D1)转录, 推动炎症与肿瘤发生。
这一分子层面的发现,也在临床样本中得到了有力证实。研究团队对 36 例结直肠癌患者的组织分析显示:肿瘤组织中 STAT3_ΔS701 亚型的含量的比例,显著高于癌旁正常组织,且其丰度与肿瘤TNM 病理分期呈显著正相关。同样,在 IBD 患者(如克罗恩病)的肠道组织中,ΔS701 占比高达 63%,远超正常组织的 27%。除此之外,更值得关注的是,目前临床与科研中广泛使用的“STAT3 活化检测抗体”(针对 Y705 磷酸化),无法识别 STAT3_ΔS701 的活化状态。这意味着,过去我们对许多患者体内 STAT3 的真实激活水平被严重低估,而这部分被忽视的“超活化“STAT3_ΔS701 亚型,极有可能才是真正驱动疾病进展的“暗流”。
为进一步探究“S701”的生理功能,研究团队构建了仅表达 STAT3_ΔS701 亚型的基因小鼠。实验结果表明:在结肠炎模型中(DSS 诱导),ΔS701 小鼠的炎症症状显著加重——体重下降更快、结肠组织损伤更严重、炎症因子水平更高,死亡率也大幅上升;同时,在“炎症-癌变”模型中(AOM/DSS 诱导),突变小鼠形成的结肠肿瘤数量更多、体积更大,肿瘤细胞的增殖活性也显著增强。团队借助骨髓移植实验进一步锁定了疾病恶化的“关键载体”: 免疫细胞。当把 ΔS701 小鼠的骨髓移植到辐照过的野生型小鼠体内时,受体小鼠对结肠炎的敏感性显著增加;反之亦然。以上研究也在临床样本种得到进一步证实,免疫细胞浸润是ΔS701 驱动炎症与癌变的核心力量。
研究团队进一步阐明控制 STAT3“分子刹车”的两个关键调控分子:激酶 mTORC1 负责“上刹车”,在炎症早期磷酸化 S701 以启动抑制信号;磷酸酶PP2A 负责“松刹车”,通过去磷酸化 p-S701 解除抑制。 生理状态下,mTORC1 与 PP2A 共同维持 STAT3 活性的动态平衡;但长期慢性炎症压力会导致 RNA 可变剪接模式“漂移”,产生更多“缺失刹车”的 STAT3_ΔS701 亚型,打破平衡。小鼠干预实验表明,特异性抑制 PP2A 活性,维持 S701 高磷酸化状态,可缓解小鼠肠炎表型。
这项研究首次揭示了“由可变剪接导致的单个氨基酸差异”对 STAT3 功能的决定性影响——通过一个精巧的“前馈刹车”机制,深刻改写了我们对结肠炎症-肿瘤转化的认知。它提醒我们,在生命复杂的调控网络中,任何一个微小的“差异”都可能蕴含巨大的生物学意义。而对蛋白异质性的深入理解,正是通往精准医学的必经之路。未来,针对 STAT3 不同亚型的特异性诊断工具与靶向药物开发,有望为 IBD 与 CRC 患者带来新的治疗希望。
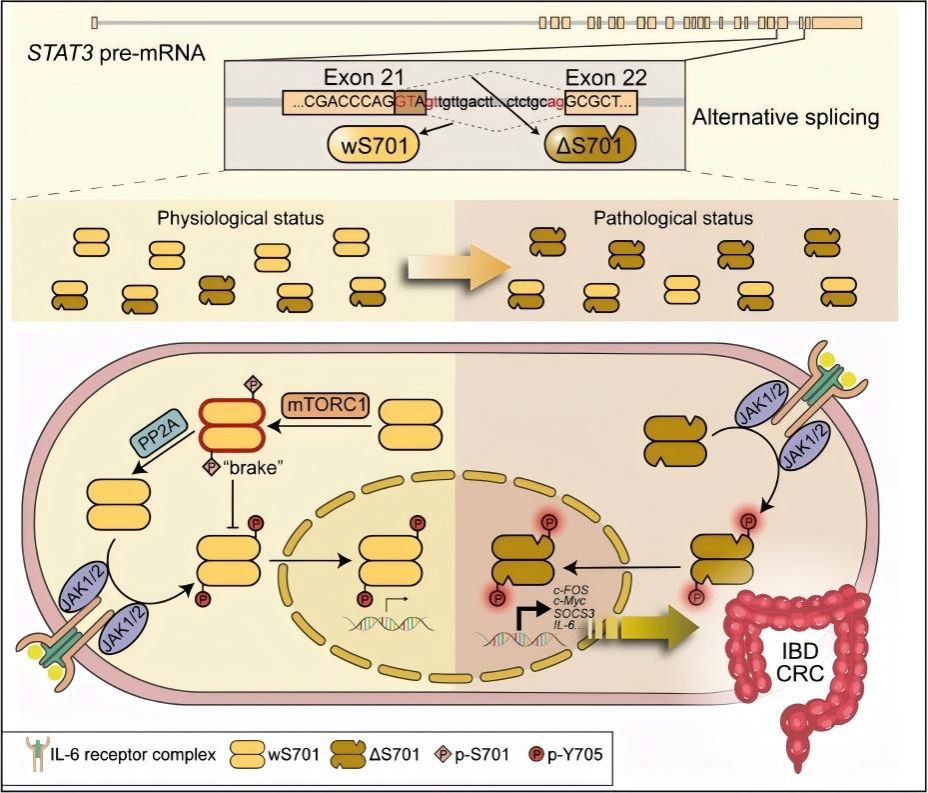
图:由隐含剪接产生的 STAT3 两种亚型对结肠炎相关肿瘤发生的调控机制示意图
华中师范大学为该研究第一完成单位,华中师范大学博士后徐梦、华中师范大学博士研究生韦定菊、钟书及武汉大学中南医院刘韦成主任医师为共同第一作者。研究工作得到国家自然科学基金、湖北省人才工程项目、国家重点研发计划、中国医学科学院医学科学创新基金等项目的大力支持。
初审初校:仝晶晶团队
复审复校:仝晶晶
终审终校:邱保胜